Istnieją dwa rodzaje gazów. Gaz rzeczywisty i gaz doskonały. Ponieważ rozmiar cząstek gazu doskonałego jest niezwykle mały, a masa jest prawie zerowa i nie ma objętości, gaz idealny jest również uważany za masę punktową. Cząsteczki prawdziwego gazu zajmują przestrzeń, chociaż są małymi cząsteczkami, a także mają objętość.
- Jaka jest różnica między ideal i real?
- Jaka jest różnica między prawdziwym gazem a idealnym gazem quizlet?
- Co masz na myśli mówiąc o prawdziwym gazie?
- Dlaczego ciśnienie gazu doskonałego to coś więcej niż prawdziwy gaz?
- Dlaczego prawdziwe gazy nie są idealne?
- Co oznacza gaz idealny?
- Co to jest gaz nieidealny?
- Dlaczego rzeczywiste gazy odbiegają od idealnego zachowania?
- Dlaczego prawdziwe gazy nie zachowują się dokładnie tak, jak gazy idealne??
- Jaki jest prawdziwy przykład gazu?
- Jakie są 4 właściwości gazu?
- Jaka jest formuła prawdziwego gazu?
Jaka jest różnica między ideal i real?
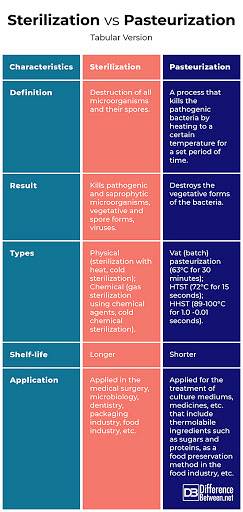
„Prawdziwy” oznacza po prostu „rzeczywistość”. Z drugiej strony „ideał” odnosi się do czegoś, co jest odpowiednie. Na przykład, gdy mówi się, że wszystkie warunki są idealne do rozpoczęcia gry, to znaczy, że są one odpowiednie. „Prawdziwe” to termin, który wykazuje oryginalność.
Jaka jest różnica między prawdziwym gazem a idealnym gazem quizlet?
Cząsteczki gazu doskonałego są bezwymiarowymi punktami. Gazy rzeczywiste nie wykazują między cząstkami sił przyciągania ani odpychania. ... Gazy rzeczywiste zachowują się jak gazy idealne, gdy znajdują się pod wysokim ciśnieniem i są w niskich temperaturach.
Co masz na myśli mówiąc o prawdziwym gazie?
Z Wikipedii, wolnej encyklopedii. Gazy rzeczywiste to gazy nieidealne, których cząsteczki zajmują przestrzeń i oddziałują; w konsekwencji nie są zgodne z prawem gazu doskonałego.
Dlaczego ciśnienie gazu doskonałego to coś więcej niż prawdziwy gaz?
dlaczego ciśnienie wywierane przez gaz doskonały na ścianki pojemnika jest większe niż w przypadku gazu rzeczywistego. Dowiedziałem się, że gazy idealne nie mają sił międzycząsteczkowych. ... Ale przy wysokim ciśnieniu, gdy cząsteczki są bliżej siebie, siły odpychające dominują nad siłami przyciągania.
Dlaczego prawdziwe gazy nie są idealne?
Żaden prawdziwy gaz nie jest idealny. Wszystkie cząsteczki mają objętość i międzycząsteczkowe siły przyciągania. Zatem „rzeczywista objętość molowa” różni się od idealnej objętości molowej.
Co oznacza gaz idealny?
Termin gaz doskonały odnosi się do hipotetycznego gazu złożonego z cząsteczek, które kierują się kilkoma zasadami: Cząsteczki gazu doskonałego nie przyciągają się ani nie odpychają. Jedyną interakcją między cząsteczkami gazu doskonałego byłoby elastyczne zderzenie przy zderzeniu ze sobą lub elastyczne zderzenie ze ściankami pojemnika.
Co to jest gaz nieidealny?
(p + V2n2a) (V − nb) = nRT gdzie a i b są stałymi dla określonego gazu, przy ciśnieniu p, objętości V, liczbie moli n i temperaturze bezwzględnej T. ... R, R jest stałą gazową, 8, punkt, 3145, J, K, do potęgi minus 1, m, o, l, do potęgi minus 1, 8.
Dlaczego rzeczywiste gazy odbiegają od idealnego zachowania?
Gazy odbiegają od idealnego zachowania, ponieważ ich cząsteczki mają między sobą siły przyciągania. Pod wysokim ciśnieniem cząsteczki gazów są bardzo blisko siebie, więc interakcje molekularne zaczynają działać i te cząsteczki nie uderzają w ściany pojemnika z pełnym uderzeniem.
Dlaczego prawdziwe gazy nie zachowują się dokładnie tak, jak gazy idealne??
Gazy rzeczywiste zachowują się jak gazy idealne, z wyjątkiem bardzo wysokiego ciśnienia. Przy stałej temperaturze ciśnienie wywierane przez jeden mol gazu spada, gdy dostępna objętość jest zwiększana. Równanie gazu doskonałego daje prawidłowe wartości tylko wtedy, gdy temperatura jest wyrażona w stopniach Celsjusza.
Jaki jest prawdziwy przykład gazu?
Każdy istniejący gaz jest gazem rzeczywistym. Azot, tlen, dwutlenek węgla, tlenek węgla, hel itp. Gazy rzeczywiste mają niewielkie siły przyciągania i odpychania między cząstkami, a gazy idealne nie. Rzeczywiste cząsteczki gazu mają objętość, a cząstki gazu doskonałego nie.
Jakie są 4 właściwości gazu?
Ponieważ większość gazów jest trudna do bezpośredniej obserwacji, są one opisane za pomocą czterech właściwości fizycznych lub charakterystyk makroskopowych: ciśnienia, objętości, liczby cząstek (chemicy grupują je według moli) i temperatury.
Jaka jest formuła prawdziwego gazu?
Stała „b” jest rzeczywistą objętością mola cząsteczek, większe wartości „b” są związane z większymi cząsteczkami. Te poprawki zastosowane do równania gazu doskonałego dają równanie Van der Waalsa dla rzeczywistego zachowania gazu. (P + an2/ V2) (V - nb) = nRT.
 Differbetween
Differbetween